我院2006届校友尚桂军团队在Molecular Cell杂志上发表研究论文
【转自Cell Press公众号】2023年4月21日,山西高等创新研究院尚桂军团队和中科院微生物所高福团队、山西农业大学卢德芬团队以及南方科技大学王培毅团队合作在Cell Press细胞出版社旗下期刊Molecular Cell 上发表了题为“The mechanism of STING autoinhibition and activation”的研究成果。研究围绕STING滞留内质网问题,证明了静息状态下STING形成高度有序的寡聚体结构是STING保持内质网滞留和自我抑制的关键因素。该研究同时也揭示了激活状态下的STING高聚体可以造成膜的弯曲,从而有利于激活后的STING在内质网出芽和囊泡上的转运。
双链DNA(double-stranded DNA, dsDNA)能够作为病原入侵和细胞受损的信号,激活机体的天然免疫。环状GMP-AMP合成酶(cyclic GMP-AMP synthase, cGAS)是胞内广泛存在的dsDNA感应器。cGAS合成的cyclic GMP-AMP (cGAMP)分子可以作为第二信使,激活接头蛋白干扰素基因刺激因子(stimulator of interferon genes, STING)。激活后的STING从内质网向高尔基体(GA)转移,利用C端尾部(CTT)募集并激活TANK结合激酶1(TANK-binding kinase,TBK1)和干扰素调节因子3(interferon regulatory factors 3,IRF3),促进干扰素刺激基因(inerferon-stimulated genes, ISGs)的表达,提高机体的免疫水平。
STING由跨膜结构域(transmembrane domain, TMD)和胞质配体结合域(ligand-binding domain, LBD)组成。前期研究认为,静息状态下STING主要定位在内质网(ER)上,以同源二聚体形式存在,同时LBD处于开放状态。当与cGAMP结合后,STING的LBD相对TMD顺时针旋转180°,同时向内收缩,上方的LBDβ2-LBD β3 loop形成由4个反向平行的β折叠片层构成的盖子(Lid)结构,将配体包在内部,导致LBD进入闭合状态,激活后的STING会以肩并肩的形式形成高度线性排列的寡聚体,随后通过CTT以头对头的方式募集TBK1,然而当前的研究尚不明确STING-cGAMP多聚体组装细节。
作为天然免疫中的关键接头蛋白,STING的异常激活与自身免疫疾病的发生息息相关。对于STING作用机制的研究,有助于提高STING在抗病毒、抗肿瘤、维持免疫稳态以及治疗自身免疫疾病中的应用。内质网滞留对于STING静息状态的维持非常重要,STING的异常迁移往往会导致STING通过非配体依赖的途径自我激活,导致SAVI、COPA综合征、C型尼曼-皮克病等病变的发生。而STING实现自我抑制和内质网滞留的方式对认识这些自身免疫疾病发病机制至关重要,虽然有文献认为内质网蛋白STIM1和STING 相互作用导致其ER滞留, 但是二者直接相互作用证据仍然缺乏。
在本研究中,围绕STING滞留内质网问题,作者猜测是否STING通过自身的寡聚形成特殊构象从而导致了其内质网滞留,首先通过非变性胶(Native PAGE)实验,作者发现静息状态下不同物种的STING均存在寡聚体,而cGAMP刺激能够提高STING寡聚体非变性胶中的稳定性,这些数据同时提示STING在静息状态和激活状态的寡聚体组装方式有所区别。借助冷冻电镜技术,作者发现静息状态下人源STING寡聚体维持一种阶梯状的头对头和肩并肩的双层分子结构(图1A),从而把两个内质网膜连接到一起,同时在其他物种(比如牛,猪,鸡)也发现静息状态下的STING以相同的方式组装,证明了这种组装方式在进化上高度保守。同时,利用超高分辨率STED显微镜和免疫电镜,观察到STING并非在内质网膜上弥散存在,而是精准定位于两个内质网管状膜之间,或内质网的三通连接处,证明了细胞内静息状态下的STING确实连接两个内质网膜。而这种组装方式,可以抑制STING从内质网到高尔基体的转运,保持STING在内质网上面的滞留,同时由于STING和TBK1以头对头的方式结合,所以在此双层结构下,STING无法与TBK1蛋白结合,抑制了该通路的激活。综上STING双层结构代表了STING的自我抑制状态。
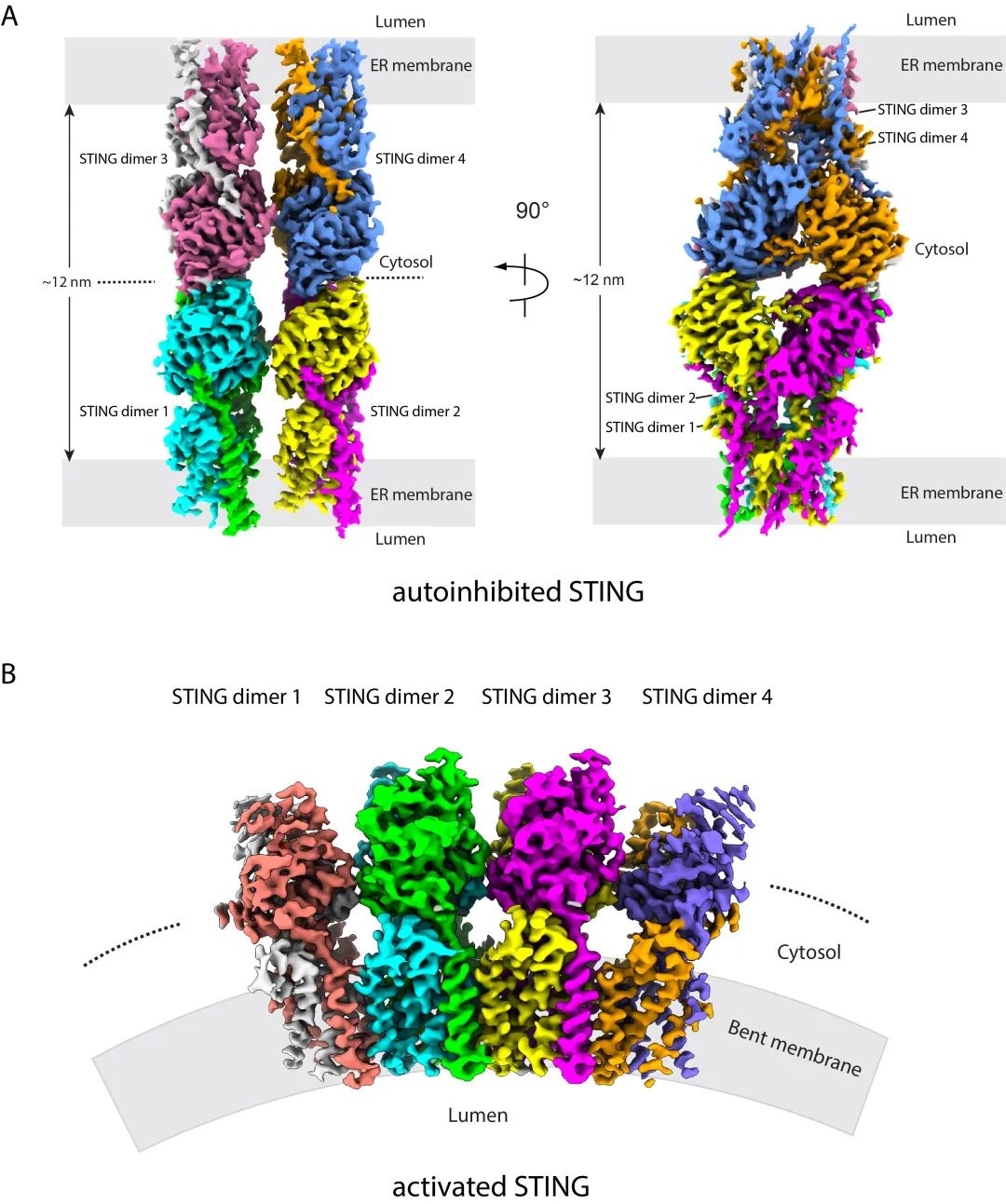
图1. A. 静息状态的STING双层结构。B. cGAMP活化的STING单层结构。
对于寡聚体结构的进一步结构解析和功能研究,发现STING-LBD介导该双层结构的形成,而STING-TMD则不参与。其中,结构元件LBD α2-LBD α3 loop 通过和相邻的相同结构元件以肩并肩的模式组装,从侧面维持STING的未激活状态。SAVI病人中发现的突变(比如V155M,R281Q)大多聚集到此区域,从而解释了此类SAVI发病分子机制。对于头对头的STING二体相互作用分析发现,一个保守的疏水性LP基序(L代表Leu,P代表Pro)介导两层STING分子之间的相互作用(图2A)。有趣的是,和以往解析的STING非活性状态开放构象不同的是,该非活性状态的STING二体中间形成一个带有盖子的关闭构象,其中一个单体中的LP基序由于翻转90°导致LBDβ2-LBD β3 loop中的β折叠片层发生位置互换后和另一个单体中的LBDβ2-LBD β3 loop的β股形成平行β折叠片层结构,不同于结合cGAMP的反平行β折叠片层结构(图2B)。基于此结构,可以推测无论是diABZI结合的STING开放构象,还是cGAMP结合的STING关闭构象,都可以打破这种新颖的盖子结构而激活STING,从而统一了此前存在争议的两种STING激活学说。
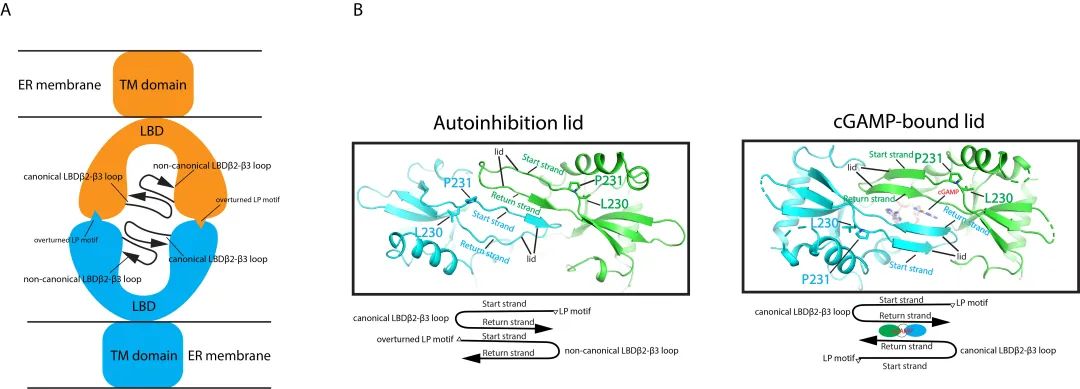
图2. A. 静息状态的STING双层结构模式图。B. STING自我抑制状态的盖子结构和cGAMP结合状态的盖子结构比较。
另外,该研究还获得了高分辨率的STING-cGAMP复合物的单层肩并肩高聚结构(图1B)。结构分析表明激活状态下STING单体间LBD和TMD均存在着相互作用。其中,LBD之间主要也是通过相邻LBD α2-LBD α3 loop结构元件介导的相互作用,和双层结构中该元件作用方式不同的是,LBD α2-LBD α3 loop主要是通过主链氢键相互作用而稳定复合物结构。同时相邻的STING二聚体间的TMD存在相互作用也是STING激活的结构特征。有趣的是,STING-cGAMP高聚体从侧面看采取弯曲的构象,而且在多个物种中均观察到弯曲、单层的STING-cGAMP高聚构象,说明STING激活后采取单层弯曲构象是进化上保守的。从功能上来说,多聚体采取弯曲的构象,改变内质网膜的曲率,有利于顺式囊膜运输的发生。
综上所述,该研究证明了静息状态下STING能够形成高度有序的寡聚体结构,通过LBD以头对头肩并肩的组装模式形成双层结构,实现内质网滞留和自我抑制;同时,激活的STING多聚体引起内质网膜曲率的变化,形成弯曲的单层结构,从而更加适应囊泡出芽和COP II介导的顺式囊膜转运(图3)。
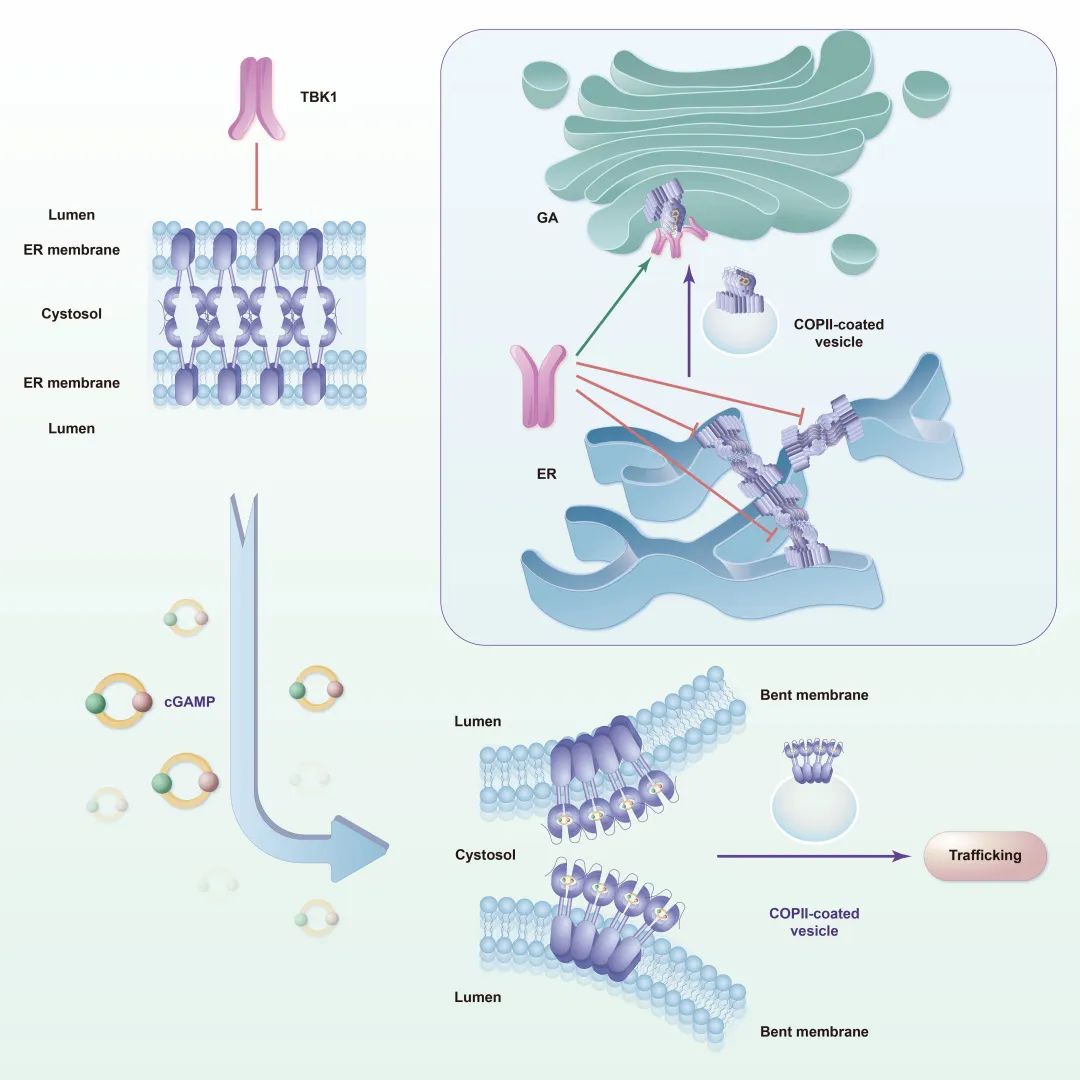
图3. STING自我抑制和激活模式图。
同时该研究提出了任何能够影响膜结构完整性、诱导膜曲率改变的因子,都能作为STING的“配体”,描绘了STING蛋白的非cGAS依赖性激活途径作用机理,解释了STING激活与胆固醇稳态之间的关系。这项工作为STING在生理和病理条件下发挥的不同功能提供了重要的科学解释,同时给未来的免疫调节药物研发提供了新的视角。
博士后刘升、副研究员杨勃、博士生侯迎香和助理研究员崔凯歌为该论文共同第一作者。山西农业大学卢德芬教授,中科院微生物所高福院士,南方科技大学王培毅教授和山西高等创新研究院尚桂军研究员为论文共同通讯作者。
【校友信息】尚桂军,男,我院2006届本科毕业生。现在山西高等创新研究院任职。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00243-5
