我院2013届校友周瑞以共同一作在Nature、Science上发表文章
【转自人民日报】在与阿尔海默茨症发病密切相关的关键蛋白研究领域,施一公研究组连下两城!
2018年12月31日和2019年1月10日,西湖大学校长、清华大学生命学院、结构生物学高精尖创新中心施一公教授领导的研究团队分别于《自然》和《科学》发表两篇长文:《人源γ-分泌酶识别底物Notch的结构机制》、《人源γ-分泌酶底物淀粉样前体蛋白的识别》,报道了人体γ-分泌酶分别结合底物Notch以及和淀粉样前体蛋白(APP)的高分辨率冷冻电镜结构。两篇论文分别揭示了了结合两种不同底物后γ-分泌酶发生的构象变化,并对这些构象变化的功能进行了生化研究,为理解γ-分泌酶特异性识别并切割底物的分子机制提供了重要认知基础,从而为研究与癌症以及阿尔兹海默症相关的特异性药物设计提供了重要的结构信息。


阿尔兹海默症患者有增无减,γ-分泌酶是药物开发的重要靶点
据这两篇长文的共同第一作者——清华大学生命学院博士后、结构生物学高精尖创新中心卓越学者杨光辉、周瑞介绍,阿尔兹海默症(AD,俗称老年痴呆症)是当今世界面临的最为严峻的神经退行性疾病。临床表现为脑组织切片中出现淀粉样斑块,神经元死亡,认知和记忆能力受损,最后脑功能严重受损直至死亡。
统计结果表明,在65岁以上人群中,其发病率高达10%;在85岁以上人群中,发病率更是达到30-50%;我国目前罹患该病的人口高达500万,约占世界患者总数的四分之一。
更为严峻的是,由于世界范围内预防治疗手段不足,缺乏特效药物,该疾病有发病年龄提前、发病人数增加的趋势,给病人及家属造成极大痛苦,也同时为社会带来沉重负担。
两位博士后指出,阿尔兹海默症的发病机理尚不明确。病人脑组织中的淀粉样斑块,是由淀粉样蛋白前体蛋白(APP)被酶切割产生的短肽聚集而来。在此切割过程中,最关键的蛋白酶是γ-分泌酶。γ-分泌酶由四个跨膜蛋白亚基组成,分别为Presenilin(PS1)、Pen-2、Aph-1和Nicastrin。
“如果把底物Notch或者APP比喻成一根绳子,那么γ-分泌酶的作用就是要把这根绳子剪成一段一段。如果切割产生异常,或者这些剪出来的小段缠绕在一起就有可能导致疾病。在γ-分泌酶的四个组分中,PS1就是那把剪刀”杨光辉说。
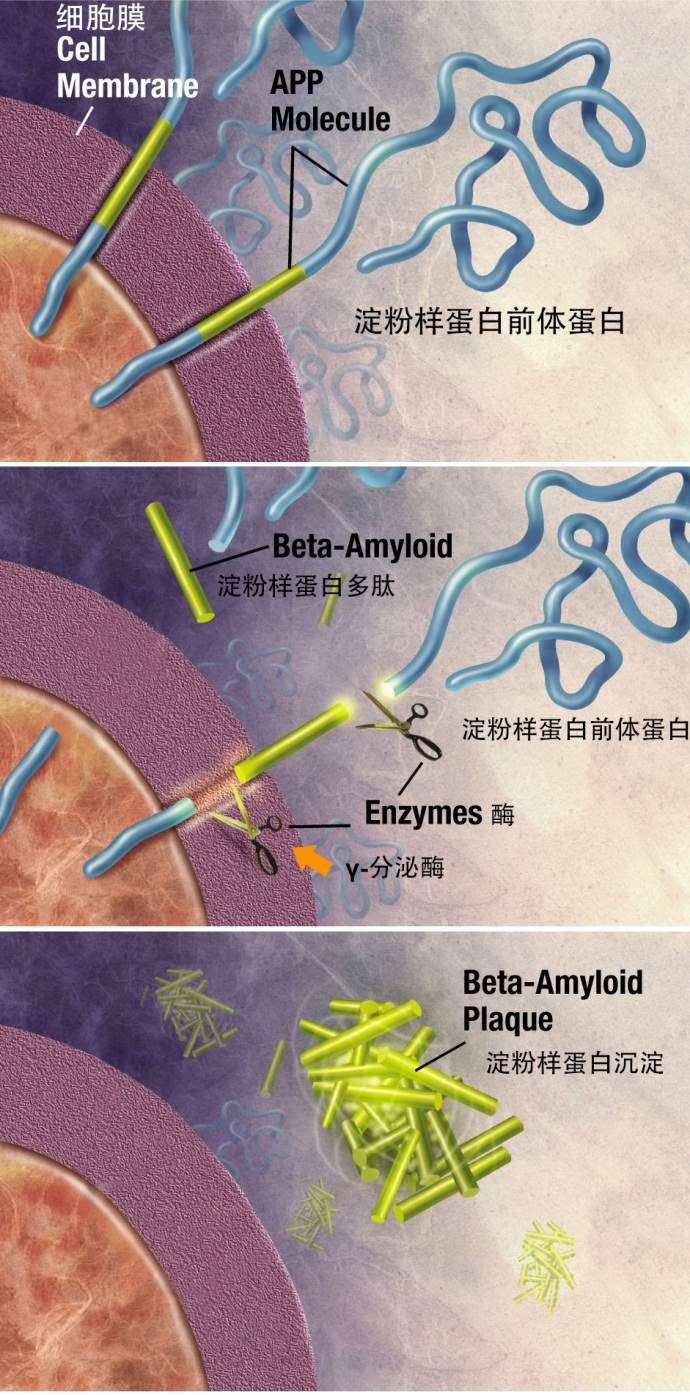
淀粉样蛋白前体蛋白(APP)被γ-分泌酶切割示意图。
周瑞告诉记者,构成PS1蛋白的基因中有200多个突变与AD病人相关,这些突变有可能导致PS1功能异常而引起阿尔兹海默症的发生。此外,除了淀粉样蛋白,重要的信号蛋白Notch也是γ-分泌酶的底物。Notch的异常切割会导致发育的异常,与一些诸如T细胞急性淋巴细胞白血病在内的癌症发病也有重要联系。“作为与阿尔兹海默症和癌症均紧密相关的蛋白,很多药物的研发直接以γ-分泌酶作为靶点,希望通过调节其活性来治疗相关疾病。”
γ-分泌酶活性抑制研发均告失败,相关机理研究缺失是主因
“遗憾的是,近年来多种旨在减少淀粉样沉淀的γ-分泌酶活性抑制剂的临床实验均宣告失败。特别是被寄以厚望的礼来公司研发的的Semagacestat,也在临床实验阶段宣告失败。”两篇长文的通讯作者施一公教授告诉记者,这些药物旨在降低γ-分泌酶这把大剪刀对淀粉样蛋白的切割,从而减少淀粉样沉淀来治疗老年痴呆症。“临床实验表明,这些抑制剂虽然能够减少对淀粉样蛋白的加工,却并不能改善患者的认知状况。更严重的是,由于抑制剂同时抑制了Notch的加工,使得AD病人罹患癌症的风险大幅增,该临床实验不得不提前终止。”
“究其原因,对γ-分泌酶结合底物机制研究的缺失是造成失败的原因之一。”施一公说,理想情况是:这台蛋白质机器只减少对淀粉样蛋白的加工,而不影响处理其他的原材料。“为此,获得γ-分泌酶与底物Notch以及前体蛋白APP复合物的结构,对研究γ-分泌酶的底物识别酶切机理和设计以γ-分泌酶为靶标的特异性药物,具有极大科学意义和潜在应用价值。”
揭开γ-分泌酶如何识别、剪切底物之谜,为药物设计提供潜在靶标
施一公教授2006年在清华大学建设实验室之初,就将揭示阿尔兹海默症的发病机理作为重点研究方向,其中一个主要环节是解析γ-分泌酶的高分辨率结构,揭示Presenilin突变体的致病机理。经过长期不懈的努力,他们自2012年以来取得一系列重要突破。这两篇文章报道是此前施一公研究组对γ-分泌酶结构与功能系统研究不断深入的延续,回答了γ-分泌酶如何识别和剪切底物这一基本问题。

施一公和杨光辉(左)、周瑞。
由于酶与底物的“结合-酶切-解离”这一过程速度极快、转瞬即逝,获得酶与底物的复合物结构难度非常大。施一公课题组通过严谨的设计和筛选,通过原位交联的办法,成功获得了γ-分泌酶分别与底物Notch和APP的稳定复合物,并解析了分辨率高达2.7埃和2.6埃(1埃=0.1纳米)的结构。
研究结果显示,γ-分泌酶与底物复合物的结构中,PS1发生了较大的构象变化。尤为值得一提的是,在跨膜区靠近细胞内的一侧,PS1通过构象变化,与底物的胞内段形成稳定的β-折叠片结构,为稳定底物提供了保证。在此状态下,底物自身的螺旋结构解开一部分,暴露出被加工的位置。研究组提出了γ-分泌酶结合底物并依次进行多步酶切的机理:底物的跨膜螺旋随着加工的进行逐步解旋,被再次加工。
此外,文章还讨论了底物进入分泌酶的路径。
毫无疑问,研发可以特异地抑制APP的加工而不影响Notch加工的药物,对于靶向治疗阿尔兹海默症且不导致副作用具有重大价值。研究组通过系统性地在结构当中比较Notch与APP部分被加工区域的区别,揭示了研发这种特异性抑制剂的潜在的结合位点。有很多与阿尔兹海默症相关的突变集中在PS1和APP上,这些突变可能会导致对APP的异常切割。其中一些会发生多种突变的位点,大多就集中在γ-分泌酶识别APP的位置。研究组通过对结构的详细分析,分类讨论了这些突变可能影响底物结合的机理。
据悉,研究组正在研究γ-分泌酶与特异抑制剂的相互作用,期望能为针对老年痴呆的药物研发提供更多基础信息。
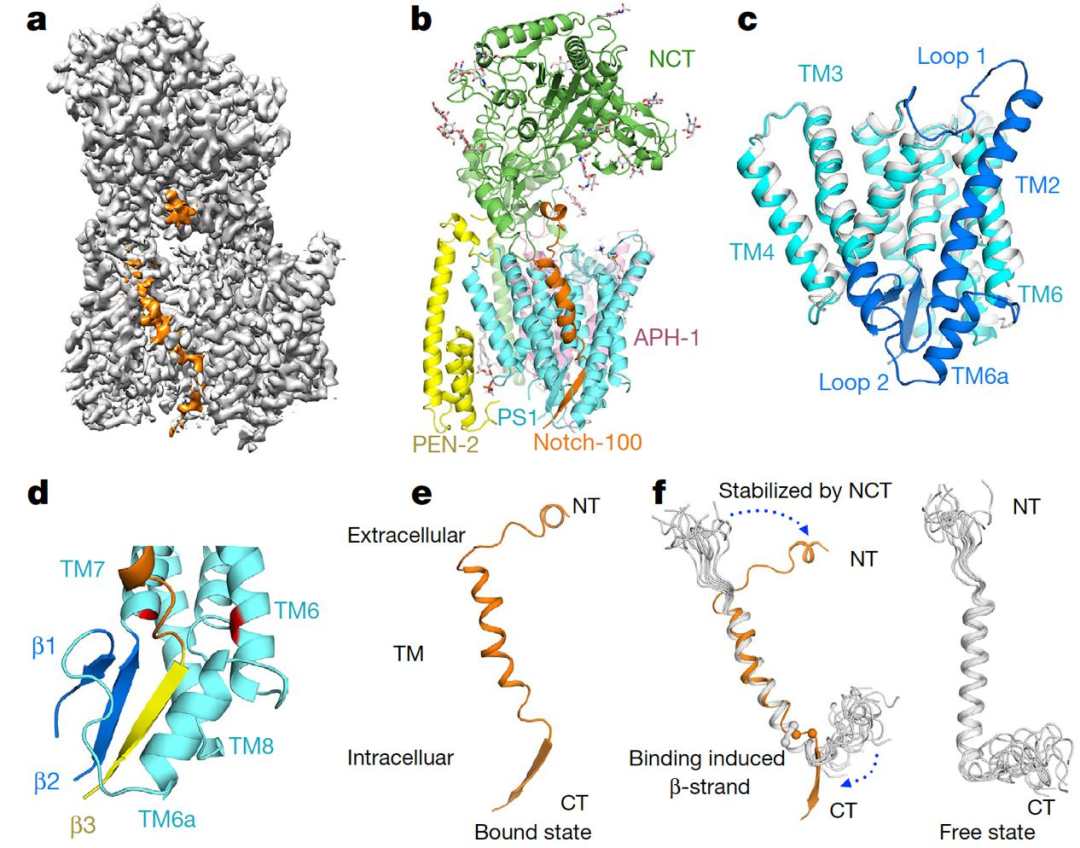
图1: γ-分泌酶结合Notch复合物的冷冻电镜结构。a. γ-分泌酶结合Notch复合物的密度图。其中橙色标记的为结合的Notch;b. γ-分泌酶结合Notch复合物结构模型;c. 底物结合与不结合状态下催化亚基PS1的结构比较,灰白色为未结合底物的状态,青色和蓝色为结合底物的状态,蓝色部分为发生变化的主要区域; d. PS1与底物跨膜区靠近细胞膜一侧形成β折叠片,从而稳定结合底物;e-f. 与γ-分泌酶结合后底物Notch发生的构象变化。橙色为结合在γ-分泌酶中的Notch构象,灰白色为未结合的构象。
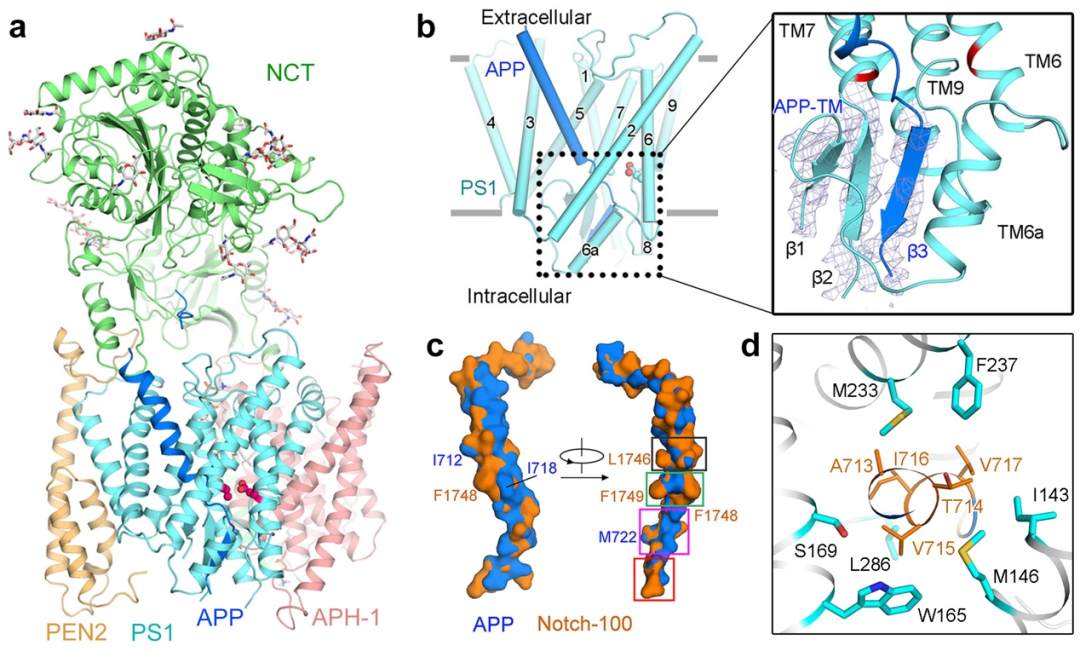
图2:γ-分泌酶结合APP复合物的冷冻电镜结构。a. γ-分泌酶结合APP复合物结构模型;b. PS1与底物APP所形成的β折叠片结构,其中一个来源于底物,另外两个片层来源于PS1;c. APP与Notch跨膜区结合γ-分泌酶状态下表面特征比较,可以观察到两种底物的具体区别;d. APP与γ-分泌酶催化亚基PS1跨膜区中部分与阿尔兹海默症相关突变分布。
【校友信息】周瑞,我院2013届生物技术专业本科毕业生,毕业后保送至清华大学直博,师从施一公院士,清华大学生命学院博士后、结构生物学高精尖创新中心卓越学者。
